
中文标题:全氟/多氟烷基物质调节抗生素抗性基因的质粒转移:氧化应激和能量支持之间的平衡.
英文标题:Per/polyfluoroalkyl substances modulate plasmid transfer of antibiotic resistance genes: A balance between oxidative stress and energy support.
文章亮点
1、低浓度的PFAS诱导促进了共轭作用,高浓度的PFAS会抑制共轭作用。
2、促进作用归因于ROS生成和膜渗透性的增强。
3、高浓度的PFAS会导致ATP缺乏。
4、L-精氨酸池耗竭导致质粒连接受到抑制。
摘要详文
新出现的污染物可以通过质粒接合加速抗生素抗性基因(ARG)从环境细菌到人类病原体的传播,对公众健康构成巨大挑战。尽管全氟烷基物质/多氟烷基物质 (PFAS) 作为持久性有机污染物的毒性作用已被了解,但仍不清楚 PFAS 是否以及如何调节 ARG 的传播。在这项研究中,我们首次报道了相对较低浓度(0.01、0.1 mg/L)的全氟辛酸(PFOA)、全氟十二烷酸(PFDoA)和全氟(2-甲基-3-氧己酸)铵(GenX)促进了质粒 RP4 在大肠杆菌内的接合转移,而质粒接合在相对高浓度(1、10 mg/L)的 PFOA、PFDoA 和 GenX 中受到抑制。
非单向缀合结果归因于ROS过量产生、细胞膜通透性增强、能量支持短缺以及L-精氨酸池耗尽的共同调节。以众所周知的PFOA为例,在相对较低的浓度(0.01、0.1 mg/L)下,其结合频率分别显着提高了1.4和3.4倍。暴露于 PFOA 会导致供体细胞的细胞膜通透性增强和 ROS 过量产生。在高浓度 PFOA(1、10 mg/L)下,尽管氧化应激和细胞膜通透性仍然增强,但大肠杆菌中 ATP 含量下降,从而抑制了结合。
转录组分析进一步表明,与精氨酸生物合成(argA、argC、argF、argG、argI)和转运(artJ、artM、artQ)途径相关的基因的表达水平显着增加。在高浓度 PFOA 下观察到细胞内精氨酸浓度不足。补充外源精氨酸后,证明精氨酸上调了接合转移相关基因(trfAp、trbBp)并恢复了PFOA处理组中转接合子的细胞数量。因此,高浓度 PFOA 下的结合抑制归因于 ATP 的短缺和 L-精氨酸库的耗尽。这些发现为了解 PFAS 的环境浓度对 ARG 接合转移的影响提供了重要见解,并更新了质粒接合的调节机制,这对于水生环境中抗生素耐药性的管理至关重要。
图文摘要

文章简介
PFAS的环境健康风险备受关注,体内和体外模型已被用来确定可能对人类和动物造成肝毒性、神经毒性和免疫毒性的潜在生物效应。研究还表明,PFAS对细菌和无脊椎动物等多种生物体具有毒性或生物放大效应。PFOA会干扰细胞膜的结构,导致细胞内活性氧 (ROS) 的积累,导致细胞氧化损伤 。尽管污水处理厂中共存的 PFAS 的微生物毒性已广为人知,但其对ARG传播的影响有限。在水生环境中,重金属和纳米颗粒等污染物已知会增强细胞内ROS的生成并激活DNA损伤诱导反应 (SOS),从而导致 ARG 接合转移增加。此外,污染物还可以通过增加细胞膜通透性和接合相关基因的表达水平来促进接合转移。因此,我们推测 PFAS 还可以通过 ROS 过量产生和增加细胞膜通透性来调节接合转移。然而,PFAS 对 ARGs 转移的影响和机制仍不清楚。
为了了解PFAS在ARG传播中的作用,本研究选择了三种典型的PFAS,包括全氟辛酸(PFOA)、全氟十二烷酸(PFDoA)和全氟(2-甲基-3-氧己酸铵)(GenX)。PFOA 在 20 世纪 70 年代被大量使用,并被作为遗留 PFAS 污染物进行测试。此外,全氟烷基链主链中的碳原子数越多,生物累积能力越高,例如PFDoA,其具有12个碳,比短链PFAS表现出更高的毒性。GenX 作为一种更安全的替代品,已在含氟聚合物制造中用于替代 PFOA。然而,最近的研究表明,GenX 会造成与 PFOA 类似甚至更严重的健康影响。综上所述,建立了大肠杆菌HB101与质粒RP4和大肠杆菌MG1655组成的接合模型,以研究PFAS对ARGs接合转移的传播风险。通过接合频率和转接合子的细胞数量来评估接合动力学。接下来,还探讨了与 ARG 转移相关的潜在机制。研究了可能参与接合转移的细胞膜通透性、ROS 产生。以PFOA为例,还检测了质粒接合基因的表达水平和ATP的相对含量。RNA测序是分析差异表达基因非常有用的工具。因此,选择这种方法来鉴定候选基因和大肠杆菌应对 PFOA 胁迫的潜在生物途径。从这项研究中获得的信息为理解 PFAS 引起的抗生素耐药性传播机制提供了新的见解。
图文内容

图1. PFAS(PFOA、PFDoA 和 GenX)调节RP4质粒转移。a-c PFAS 在低浓度 (0.01, 0.1 mg/L) 下促进接合质粒的转移,而高浓度 (1, 10 mg/L) 则降低接合频率 (N = 3, p < 0.05)。D或R分别代表由转接合子/供体或受体获得的接合频率。d-f 暴露于PFAS下的转接合子的细胞数。

图2. PFAS对细胞膜通透性的影响。a 不同PFAS剂量对应的细胞膜通透性变化倍数。b 供体大肠杆菌HB101在PFOA暴露下细胞膜基因表达水平的倍数变化。c 未经处理或经PFOA (1, 10 mg/L) 处理的受体的TEM图像。

图3. PFAS增强大肠杆菌的氧化应激。a. 供体中ROS产生的倍数变化 b. PFOA暴露下的 CAT 酶活性。c、d 在PFOA暴露下使用和不使用ROS清除剂时转接合子的细胞数和接合转移频率。e 供体中与SOS反应和 ROS 相关的基因的转录表达水平。

图4. PFOA通过限制能量驱动机器减少质粒接合。a、b 分别对应于供体和受体中不同浓度的PFOA的ATP相对含量的变化。c 暴露于PFOA (0.01, 1.0 mg/L) 的大肠杆菌HB101中负责电子传递链 (ETC) 的基因的转录表达。
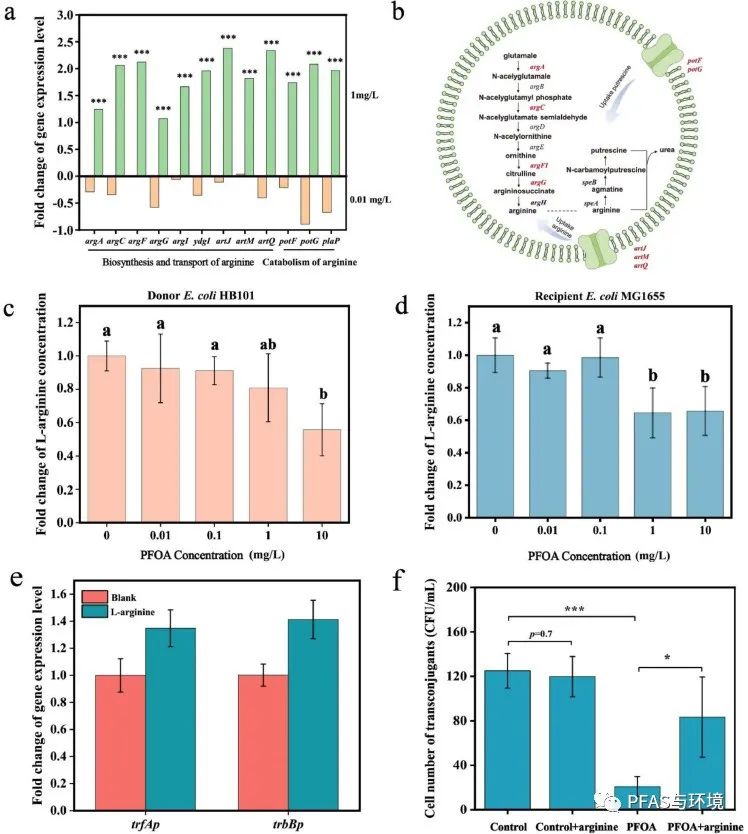
图5. L-精氨酸池耗尽通过下调质粒接合装置抑制质粒接合。a 暴露于 PFOA(0.01、1.0 mg/L)的大肠杆菌HB101中负责L-精氨酸生物合成、运输和分解代谢的基因的转录表达。b L-精氨酸生物合成、运输和分解代谢途径的图示。c、d 供体和受体中不同PFOA浓度对应的L-精氨酸相对浓度变化。e 空白组和用外源L-精氨酸(1 mM)处理的PFOA(10 mg/L)组中基因trfAp和trbBp的mRNA表达。f 在 10 mg/L 的PFOA下,含有外源 L-精氨酸 (1 mM) 的转接合子的细胞数。
主要发现
研究了全氟烷基/多氟烷基物质对共轭转移频率的影响和机制。值得注意的是,亚抑制浓度的PFAS对质粒接合的影响呈现出非单向的趋势,低浓度有促进作用,高浓度有抑制作用。本文强调,非单向缀合频率是由 ROS过量产生、膜通透性增强、ATP短缺以及细胞内L-精氨酸消耗共同调节造成的。以众所周知的PFOA为例,其促进作用主要归因于低浓度暴露(0.01、0.1mg/L)下细胞膜通透性增加和ROS过量产生,而细胞内ATP含量和L-精氨酸没有变化浓度。然而,在高浓度的PFOA(0.01、0.1 mg/L)下,细胞内ATP含量和L-精氨酸浓度的降低导致接合转移受到抑制。由于低浓度的PFAS是污水处理厂中的典型浓度,因此应注意PFAS对污水处理厂中质粒接合的促进作用。尽管GenX 被认为是PFOA的更安全替代品,但仍然存在传播ARG的风险。然而,研究仍存在一些局限性。该研究仅在纯培养大肠杆菌模型中探讨了PFAS对ARG接合转移的影响。此外,仅选择了三种PFAS来调查ARGs转移风险。总的来说,该研究拓宽了人们对PFAS对 ARG传播的潜在风险的认识。应特别关注PFAS引起的ARG在河流、沉积物和土壤等环境生态系统中的传播风险。此外,FPAS在人体中的生物富集不仅直接引发健康风险,还可能影响ARGs在人体微生物群中的传播,增加对人类健康的威胁。未来需要进行更多的研究来评估其他PFAS对污水处理厂和自然生态系统微生物群落水平上的ARG传播的影响。
文章DOI:10.1016/j.watres.2023.120086.
论文链接:https://www.sciencedirect.com/science/article/pii/S0043135423005225?via%3Dihub


