
第一作者:郑天颖,侯杰
通讯作者:侯杰,林道辉
通讯单位:浙江大学环境与资源学院
文章链接:https://doi.org/10.1021/acs.est.4c03133
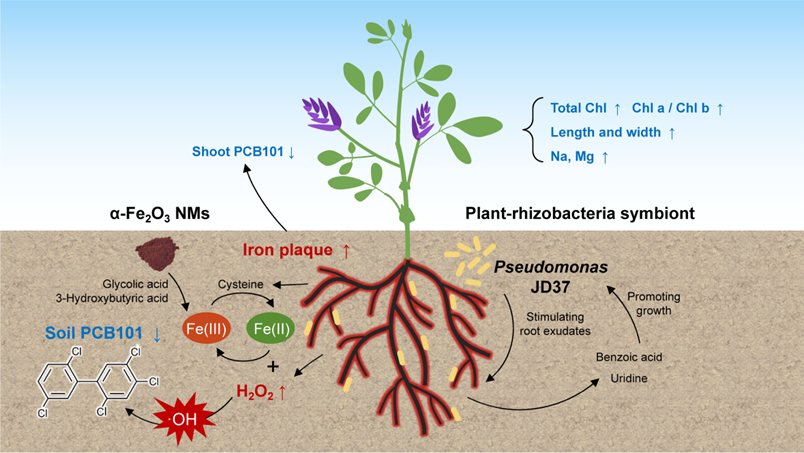
近日,浙江大学生态文明研究院生态治理方向林道辉教授团队在环境领域著名学术期刊Environmental Science & Technology上发表了题为“Ferric Oxide Nanomaterials and Plant-Rhizobacteria Symbionts Cogenerate Iron Plaque for Removing Highly Chlorinated Contaminants in Dryland Soils”的论文。该研究针对农田土壤中的高氯代污染物五氯联苯(PCB101),通过α-Fe2O3 纳米材料与植物-根际菌共生体的相互作用,构建了协同修复体系,突破了旱地条件下植物根表铁膜难以形成的瓶颈,诱导苜蓿根际芬顿反应实现PCB101的原位氧化去除,有望拓宽铁基纳米材料在有机污染农田土壤边生产边修复中的应用。
引 言
铁基纳米材料不仅可以通过缓释铁营养促进作物生长,还能通过吸附和氧化还原作用有效降解有机污染物,有望用于保障作物产量与安全。植物根表铁膜被认为是铁基纳米材料对作物产生有益作用的关键介质,它不仅是抵御污染物向上迁移的屏障,还是具有降解污染物能力的界面活性氧(ROS)载体。在以往研究中,由于苛刻的淹水厌氧条件,铁膜仅被报道存在于湿地植物的根表,如水稻、芦苇、柳树、互花米草等。考虑到淹水种植环境占农田土壤的比例较为有限,必需的淹水条件限制了铁基纳米材料在农业中的应用范围。
那么在非淹水条件下是否能够调控形成根表铁膜呢?从机制上来说,湿地植物根表铁膜的形成主要是Fe(Ⅱ)被根分泌的氧气氧化后在根表面沉淀的过程。除此之外,一些非生物和生物因素,包括土壤pH、Eh、铁氧化/还原根际菌,均可以通过调节游离铁离子及其氧化还原循环来影响铁膜形成。然而旱地由于缺乏溶解的、游离态的铁离子,上述化学过程难以发生。铁基纳米材料可以向土壤环境提供可被生物利用的铁源,但由于缺乏自然的溶解-沉淀条件,铁离子和铁膜的产生依然受到限制。最新研究表明,根际共生菌可能通过刺激植物分泌物等途径改变根际铁的地球化学循环,有望用于介导旱地土壤中根际铁膜的形成。
本研究选取紫花苜蓿(一种牧草兼修复植物)、α-Fe2O3 纳米材料和假单胞菌Pseudomonas chlororaphis JD37构建复合体系,在促进苜蓿安全生产的同时长效去除土壤中PCB101。首先通过120天的盆栽实验,评估α-Fe2O3 纳米材料和植物-根际菌共生体的对PCB101污染土壤中苜蓿安全生产和PCB101消减的影响;重点阐明了苜蓿根际微界面环境介导铁膜形成的机制,并通过模拟实验验证了·OH自由基介导芬顿反应氧化去除PCB101的原理。研究结果有望指导铁基纳米材料和植物-根际菌共生体在可持续农业领域的应用。
图文导读
α-Fe2O3 纳米材料与JD37共同促进PCB101污染土壤中苜蓿生长
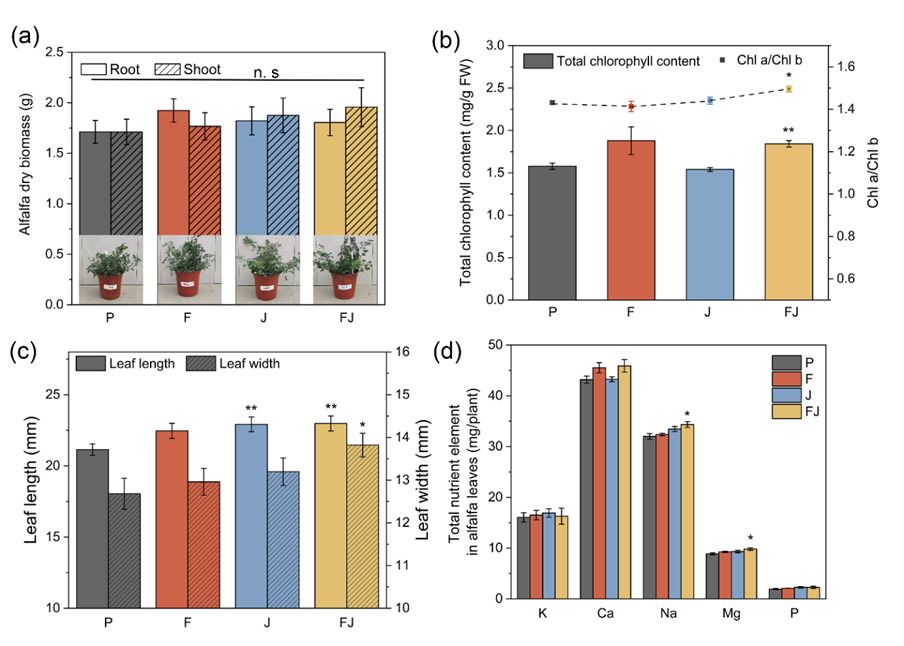
图1. 1000 mg/kg α-Fe2O3 纳米材料、1.5×109 CFU/株JD37及二者共同培育120天后苜蓿植株的生长指标
首先评估了α-Fe2O3 纳米材料与JD37单独或联合作用对PCB101污染土壤中苜蓿生长的影响。如图1所示,1000 mg/kg α-Fe2O3 纳米材料与1.5×109 CFU/株JD37联合未改变苜蓿生物量,但显著促进了苜蓿叶中叶绿素含量(18.6%)、叶绿素a/b比值(4.8%)、叶长(8.7%)和叶宽(9.0%)、叶中Na(7.3%)和Mg(10.4%)含量。联合处理增加了苜蓿对Na、Mg的吸收,同时增加了叶绿素含量、叶绿素a/b比和叶片面积,这可能是污染土壤中苜蓿健康生长的原因之一。
富含Fe(II)硅酸盐的铁膜是抵御PCB101的重要屏障
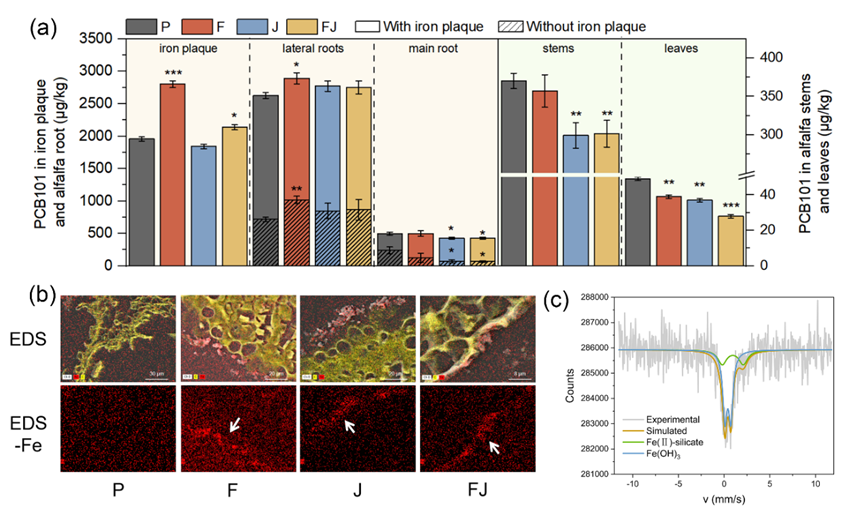
图2. 铁膜的PCB101阻控作用及其成分表征
除了产量和营养水平,污染物在作物组织内的积累量也是农业安全的重要评价指标。如图2所示,α-Fe2O3 纳米材料和JD37联合处理显著降低了紫花苜蓿叶中的PCB101含量(28.3±0.5 μg/kg,约为对照的57.1%)。根据已有研究,探究了阻控污染物向植物地上部迁移的三个主要机制。结果表明,在联合处理组中,调控POPs转运的mlp基因(图S3)和根表脂肪层(图S4)均未明显增强。借助SEM-EDS,在处理组的苜蓿根表观察到了明显的铁聚集层;联合处理组铁膜中的PCB101含量显著高于对照组,同时在纯水超声去除铁膜的苜蓿侧根和主根中,PCB101含量均显著下降。这些结果表明,铁膜是PCB101积累重要的汇集场所,阻碍了PCB101向苜蓿组织的迁移。穆斯堡尔谱结果表明,铁膜主要由Fe(II)层状硅酸盐(20.3%)和Fe(OH)3(79.7%)组成。这暗示苜蓿根分泌了某些能够溶解和还原铁矿物的代谢物,产生Fe2+作为中间产物,促进富含二价铁的铁膜形成。
α-Fe2O3纳米材料与植物-根际菌共生体的互作为芬顿根际反应提供了关键要素
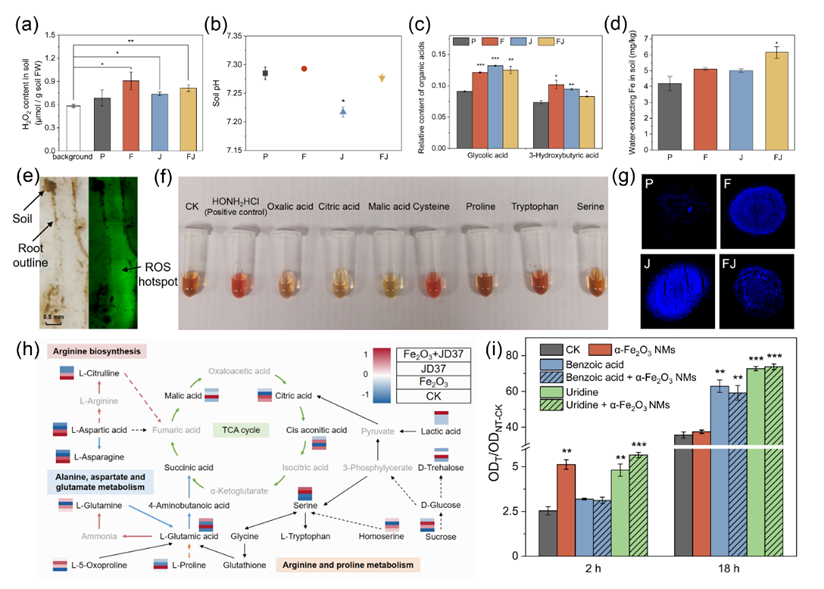
图3. 参与芬顿反应和植物-根际菌共生体形成的关键要素
芬顿反应是指在酸性环境下,Fe2+催化H2O2生成·OH,从而氧化降解各种有机污染物的化学过程。因此,在本实验体系下的根际界面验证了H2O2、酸、铁三个关键要素的存在(图3)。首先,与苜蓿根表面接触后的聚酰胺膜上观察到ROS探针标记的绿色荧光,表明苜蓿根表能够释放H2O2,且根际土壤中H2O2含量显著高于未种植土壤。其次,根际土壤pH比播种前降低了0.40 ~ 0.47个单位。其中,JD37处理导致土壤pH轻微但显著降低。JD37单独及联合处理增加了苜蓿根中羟基乙酸(pKa = 3.83)和3-羟基丁酸(pKa = 4.36)的含量,诱导根际环境酸化和铁矿物溶解。最后,在多种具有还原潜力的根代谢物中,半胱氨酸与Fe3+反应生成Fe2+的活性最高,与邻菲罗啉反应生成最鲜艳的红色配合物;借助半胱氨酸探针,观察到处理组的荧光强度高于对照组,证明α-Fe2O3 纳米材料和/或JD37诱导了半胱氨酸的生成。
此外,研究了侧根代谢物对α-Fe2O3 纳米材料和JD37的综合响应。代谢组学结果表明,JD37处理组中一些代谢物的含量下降,尤其是氨基酸(如鸟氨酸和天冬氨酸)和羧酸(如苹果酸和柠檬酸),我们猜测这可能是由于JD37有其“偏好”的代谢物。代谢物验证实验表明,仅在JD37处理和共处理根中检测到的苯甲酸和尿苷促进了JD37的增殖,且α-Fe2O3 纳米材料对JD37的增殖有进一步的推动作用,强化了苜蓿与JD37的互利共生。
根际芬顿反应生成的·OH主导了PCB101的氧化降解
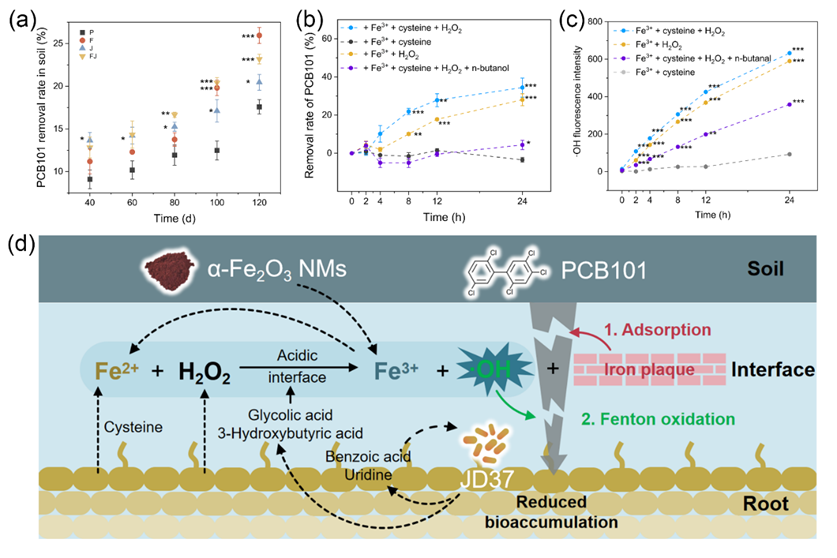
120天后,α-Fe2O3纳米材料单独及联合处理组中,铁膜中的PCB101含量以及土壤PCB101的消减率均显著高于对照组。如图4所示,土壤PCB101的消减率分别比对照组高8.4% (p < 0.001)和5.6% (p = 0.003)。这些结果表明,铁膜是PCB101富集和降解的热区。利用半胱氨酸、Fe3+和H2O2等根际化合物进行的短期模拟溶液实验结果显示,Fe3+和H2O2可以降解去除PCB101,同时产生OH;且半胱氨酸的加入进一步提高了PCB101的去除率和OH的累积量。并且,添加/不添加半胱氨酸的条件下,芬顿反应中PCB101的去除率与OH水平均呈显著正相关。正丁醇淬灭OH的实验结果进一步证明OH是介导PCB101降解的关键ROS。总体而言,α-Fe2O3 纳米材料与植物-根际菌共生体的相互作用提供了足够的铁离子,并形成了还原性微界面,促进了根际芬顿反应的发生和铁膜的形成,实现了PCB101的根际固定和氧化降解。
小 结
本研究突破了旱地植物根表铁膜形成的瓶颈,将α-Fe2O3铁基纳米材料与苜蓿-根际菌共生体结合,通过侧根中的半胱氨酸和低分子量有机酸还原生成Fe2+并提供根基酸性微环境,与H2O2共同介导根际芬顿反应,促进了富含二价铁硅酸的铁膜形成,实现了持久性高氯代有机污染物的长效氧化降解。相关研究结果有助于深化对纳米材料与植物-微生物在根际环境中相互作用的认识,推动铁基纳米材料在农田土壤有机污染治理和作物安全生产领域的应用。
本研究得到国家自然科学基金(U21A20163、42192573和22376181)、国家重点研发计划(2022YFC3702100)和浙江省“领雁”研发攻关计划项目(2024C03228)支持。


